Alphavirus
| Alphavirus | ||||||||
|---|---|---|---|---|---|---|---|---|
 Структура и геном альфавируса | ||||||||
| Научная классификация | ||||||||
|
Реалм: Царство: Тип: Класс: Порядок: Семейство: Тогавирусы (Togaviridae) Род: Alphavirus |
||||||||
| Международное научное название | ||||||||
| Alphavirus | ||||||||
| Дочерние таксоны | ||||||||
|
||||||||
| Группа по Балтимору | ||||||||
| IV: (+)оцРНК-вирусы | ||||||||
| ||||||||
Alphavirus — род РНК-вирусов, единственный род в семействе Togaviridae. Альфавирусы принадлежат к группе IV Балтиморской классификации вирусов с одноцепочечным геномом (+)РНК. Существует 32 альфавируса, которые заражают различных позвоночных, таких как люди, грызуны, рыбы, птицы и более крупных млекопитающих, таких как лошади, а также беспозвоночных. Альфавирусы, которые могут инфицировать как позвоночных, так и членистоногих, называются альфавирусами с двойным хозяином, в то время как альфавирусы, специфичные для насекомых, такие как вирус Эйлат и вирус Яда-яда, ограничены их компетентным переносчиком из членистоногих[2]. Передача между видами и отдельными особями происходит в основном через комаров, что делает альфавирусы членом коллекции арбовирусов или вирусов, переносимых членистоногими. Частицы альфавируса имеют оболочку диаметром в 70 нм, сферической формы (существует некоторый плеоморфизм). Нуклеокапсид изометрический 40 нм в диаметре[3].
Геном
[править | править код]| Alpha_E1_glycop | |
|---|---|
 Кристаллическая структура гомотримера слитого гликопротеина Е1 из вируса леса Семилки | |
| Идентификаторы | |
| Символ | Alpha_E1_glycop |
| Pfam | PF01589 |
| SCOP | 1rer |
| SUPERFAMILY | 1rer |
| TCDB | 1.G |
| OPM superfamily | 109 |
| OPM protein | 1rer |
| Доступные структуры белков | |
| Pfam | структуры |
| PDB | RCSB PDB; PDBe; PDBj |
| PDBsum | 3D-модель |
| Alpha_E2_glycop | |
|---|---|
 Картирование гликопротеина Е2 альфавирусов | |
| Идентификаторы | |
| Символ | Alpha_E2_glycop |
| Pfam | PF00943 |
| TCDB | 1.G |
| OPM superfamily | 109 |
| OPM protein | 2yew |
| Доступные структуры белков | |
| Pfam | структуры |
| PDB | RCSB PDB; PDBe; PDBj |
| PDBsum | 3D-модель |
| Alpha_E3_glycop | |
|---|---|
 | |
| Идентификаторы | |
| Символ | Alpha_E3_glycop |
| Pfam | PF01563 |
| TCDB | 1.G |
| OPM superfamily | 109 |
| Доступные структуры белков | |
| Pfam | структуры |
| PDB | RCSB PDB; PDBe; PDBj |
| PDBsum | 3D-модель |
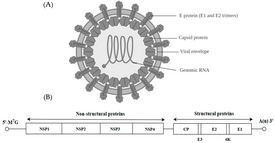
Альфавирусы представляют собой маленькие, сферические, оболочечные вирусы с геномом, состоящим из одной нити РНК с положительной полярностью. Общая длина генома колеблется от 11 000 до 12 000 нуклеотидов и имеет 5'-кэп и 3'- поли-А-хвост. Четыре гена неструктурных белков кодируются в 5'-двух третях генома, тогда как три структурных белка транслируются с субгеномной мРНК, коллинеарной 3'-трети генома.
В геноме есть две открытые рамки считывания (ОРС): неструктурная и структурная. Первый неструктурный и кодирует белки (nsP1–nsP4), необходимые для транскрипции и репликации вирусной РНК. Второй кодирует три структурных белка: основной нуклеокапсидный белок С и оболочечные белки Р62 и Е1, которые связываются в виде гетеродимера. Поверхностные гликопротеины вируса, закрепленные на мембране, ответственны за распознавание рецепторов и проникновение в клетки-мишени посредством слияния мембран.
Структурные белки
[править | править код]Протеолитическое созревание Р62 в Е2 и Е3 вызывает изменение поверхности вируса. Вместе E1, E2 и иногда E3 гликопротеиновые «шипы» образуют димер E1/E2 или тример E1/E2/E3, где E2 простирается от центра к вершинам, E1 заполняет пространство между вершинами, а E3 может рисутствовать на дистальном конце шипа[3]. При воздействии на вирус кислотностью эндосомы E1 отделяется от E2 с образованием гомотримера E1, который необходим для стадии слияния, чтобы свести вместе клеточные и вирусные мембраны. Альфавирусный гликопротеин E1 представляет собой слитый белок вируса класса II, который структурно отличается от слитых белков класса I, обнаруженных в вирусе гриппа и ВИЧ. Структура вируса леса Семлики показала структуру, аналогичную структуре флавивирусного гликопротеина Е, с тремя структурными доменами в той же первичной последовательности[4]. Гликопротеин Е2 взаимодействует с нуклеокапсидом через свой цитоплазматический домен, а его эктодомен отвечает за связывание с клеточным рецептором. Большинство альфавирусов теряют периферический белок Е3, но у вирусов Семлики он остается связанным с вирусной поверхностью.
Неструктурные белки
[править | править код]Четыре неструктурных белка (nsP1–4), которые продуцируются как один полипротеин, составляют механизм репликации вируса[5]. Процессинг полипротеина происходит строго регулируемым образом, при этом расщепление в месте соединения P2/3 влияет на использование матрицы РНК во время репликации генома. Этот участок расположен у основания узкой расщелины и труднодоступен. После расщепления nsP3 создает кольцевую структуру, окружающую nsP2. Эти два белка имеют обширный интерфейс.
Мутации в nsP2, которые продуцируют нецитопатические вирусы или фенотипы, чувствительные к температуре, кластеризуются в области интерфейса P2/P3. Мутации P3, расположенные напротив нецитопатических мутаций nsP2, предотвращают эффективное расщепление P2/3. Это, в свою очередь, влияет на инфекционность РНК, изменяя уровни продукции вирусной РНК.
Вирусология
[править | править код]Вирус имеет диаметр 60–70 нанометров. Он имеет оболочку, сферическую форму и имеет геном РНК с положительной цепью размером ~ 12 килобаз. Геном кодирует два полипротеина. Первый полипротеин состоит из четырех неструктурных единиц: по порядку от N-конца к С-концу - nsP1, nsP2, nsP3 и nsP4. Второй представляет собой структурный полипротеин, состоящий из пяти экспрессионных единиц: от N-конца до С-конца - Капсид, Е3, Е2, 6К и Е1. Субгеномная РНК с положительной цепью - 26S РНК - реплицируется из промежуточной РНК с отрицательной цепью. Это служит матрицей для синтеза вирусных структурных белков. Большинство альфавирусов имеют консервативные домены, участвующие в регуляции синтеза вирусной РНК.
Нуклеокапсид диаметром 40 нанометров содержит 240 копий капсидного белка и имеет икосаэдрическую симметрию T = 4. Вирусные гликопротеины Е1 и Е2 встроены в липидный бислой. Одиночные молекулы Е1 и Е2 связываются с образованием гетеродимеров. Гетеродимеры Е1-Е2 образуют контакты один к одному между белком Е2 и мономерами нуклеокапсида. Белки Е1 и Е2 опосредуют контакт между вирусом и клеткой-хозяином.
Было идентифицировано несколько рецепторов. К ним относятся запретин, фосфатидилсерин, гликозаминогликаны и β-субъединица АТФ-синтазы.
Репликация происходит в цитоплазме, особенно в областях, называемых «сферулами», отделенных от остальных инвагинациями плазматической мембраны. Каждый комплекс занимает одну такую область с внутренним диаметром около 50 нм[6].
Вирионы созревают путем почкования через плазматическую мембрану, где ассимилируются кодируемые вирусом поверхностные гликопротеины Е2 и Е1. Эти два гликопротеина являются мишенями многочисленных серологических реакций и тестов, включая нейтрализацию и ингибирование гемагглютинации. Альфавирусы проявляют различную степень антигенной перекрестной реактивности в этих реакциях, и это формирует основу для семи антигенных комплексов, 32 видов и многих подтипов и разновидностей. Белок Е2 содержит большинство нейтрализующих эпитопов, в то время как белок Е1 содержит более консервативные перекрестно-реактивные эпитопы.
Эволюция
[править | править код]Изучение таксона предполагает, что данная группа вирусов имеет морское происхождение, конкретно из области Южного океана, откуда впоследствии они распространились как в Старый, так и в Новый Свет[7].
В этом роде есть три подгруппы: подгруппа вирусов Semliki Forest (вирусы Semliki Forest, O'nyong-nyong и Ross River); подгруппа вируса восточного энцефалита лошадей (вирусы восточного энцефалита лошадей и венесуэльского энцефалита лошадей) и подгруппа вируса Синдбис[8]. Вирус Синдбис, географически ограниченный Старым Светом, более тесно связан с подгруппой восточного лошадиного энцефалита, которая относится к вирусам Нового Света, чем с подгруппой вирусов Семлики, которая также встречается в Старом Свете.
Таксономия
[править | править код]К роду отнесены следующие виды:[9]
Семь комплексов:
- Вирусный комплекс Бармах Форест
- Восточный комплекс лошадиного энцефалита
- Вирус восточного энцефалита лошадей (семь антигенных типов)
- Вирусный комплекс Мидделбург
- Вирусный комплекс Ндуму
- Вирусный комплекс леса Семлики
- Вирус Бебару
- Вирус чикунгунья
- Гета вирус
- Вирус Маяро
- Подтип: вирус Una
- Вирус О'ньонг'ньонг
- Подтип: вирус Игбо-Ора
- Вирус реки Росс
- Подтип: вирус Сагияма
- Вирус леса Семлики
- Подтип: Me Tri вирус
- Комплекс венесуэльского лошадиного энцефалита
- Вирус Кабассу
- Вирус Эверглейдс
- Вирус Моссо дас Педрас
- Вирус Мукамбо
- Вирус парамана
- Вирус Пиксуна
- Вирус Рио-Негро
- Вирус трокара
- Подтип: вирус Bijou Bridge
- Вирус венесуэльского лошадиного энцефалита
- Комплекс западного лошадиного энцефалита
- Ауравирус
- Вирус Бабанки
- вирус Кызылагач
- Вирус Синдбис
- вирус Окельбо
- Ватароа вирус
- Рекомбинанты в этом комплексе
- Вирус Багги Крик
- Вирус Форт-Морган
- Вирус Хайлендс J
- Вирус западного энцефалита лошадей
- Неклассифицированные вирусы
- Эйлат вирус
- Альфавирус мвинилунга
- Альфавирус лосося
- Вирус южного морского слона
- Тонат вирус
- Вирус Каэнгуа[10]
Заметки
[править | править код]Вирус леса Бармах связан с вирусом леса Семлики. Вирус Мидделбурга, хотя и классифицируется как отдельный комплекс, может быть членом группы вирусов леса Семлики.
Вполне вероятно, что этот род произошел в Старом Свете от переносимого насекомыми растительного вируса[11].
Вирус Синдбис, возможно, возник в Южной Америке[12]. Вирусы энцефалита лошадей и вирус Синдбис родственны.
Вирусы Старого Света и Нового Света, по-видимому, разошлись между 2000 и 3000 лет назад[13]. Расхождение между вирусом венесуэльского лошадиного энцефалита и восточным вирусом лошадей, по-видимому, произошло ~ 1400 лет назад[14].
Клада вирусов, заражающая рыбу, кажется базальной по отношению к другим видам.
Вирус южного морского слона, по-видимому, связан с кладой Sinbis.
Патогенез и иммунный ответ
[править | править код]| Вирус | Человеческое заболевание | Природный резервуар среди позвоночных | Географическое распространение |
|---|---|---|---|
| Вирус Бармах Форест |
|
Люди | Австралия |
| вирус чикунгунья | Сыпь, артрит | Приматы, люди | Африка, Латинская Америка, Индия, Юго-Восточная Азия |
| Вирус восточного лошадиного энцефалита | Энцефалит | Птицы | Америка |
| Вирус Маяро | Сыпь, артрит | Приматы, люди | Южная Америка |
| Вирус О'ньонг'ньонг | Сыпь, артрит | Приматы, Люди | Африка |
| Вирус реки Росс | Сыпь, артрит | Млекопитающие, люди | Австралия, южная часть Тихого океана |
| Вирус леса Семлики | Сыпь, артрит | Птицы | Африка |
| Вирус Синдбис | Сыпь, артрит | Птицы | Европа, Африка, Австралия |
| тонат вирус | Энцефалит | Люди | Южная Америка |
| Уна вирус | Сыпь, артрит | Приматы, люди | Южная Америка |
| Вирус венесуэльского лошадиного энцефалита | Энцефалит | Грызуны, лошади | Америка |
| Вирус западного энцефалита лошадей | Энцефалит | Птицы, млекопитающие | Северная Америка |
В мире распространено множество альфавирусов, способных вызывать заболевания человека. Инфекционный артрит, энцефалит, сыпь и лихорадка являются наиболее часто наблюдаемыми симптомами. Более крупные млекопитающие, такие как люди и лошади, обычно являются тупиковыми хозяевами или играют незначительную роль в передаче вируса; однако в случае венесуэльского энцефалита лошадей вирус в основном амплифицируется у лошадей. В большинстве других случаев вирус сохраняется в природе у комаров, грызунов и птиц.
Наземные альфавирусные инфекции распространяются насекомыми-переносчиками, такими как комары. После укуса человека зараженным комаром вирус может попасть в кровоток, вызывая виремию. Альфавирус также может проникать в ЦНС, где он способен расти и размножаться в нейронах. Это может привести к энцефалиту, который может привести к летальному исходу.
Когда человек заражен этим конкретным вирусом, его иммунная система может играть роль в уничтожении вирусных частиц. Альфавирусы способны вызывать продукцию интерферонов. Также участвуют антитела и Т-клетки. Нейтрализующие антитела также играют важную роль в предотвращении дальнейшего заражения и распространения.
Диагностика, профилактика и контроль
[править | править код]Диагноз ставится на основании клинических образцов, из которых можно легко выделить и идентифицировать вирус. В настоящее время вакцин против альфавируса не существует. Борьба с переносчиками с помощью репеллентов, защитной одежды, уничтожения мест размножения и опрыскивания являются предпочтительными профилактическими мерами.
Исследовательская работа
[править | править код]Альфавирусы представляют интерес для исследователей генной терапии, в частности, вирус Росс-Ривер, вирус Синдбиса, вирус лесов Семлики и вирус венесуэльского конского энцефалита использовались для разработки вирусных векторов для доставки генов. Особый интерес представляют химерные вирусы, которые могут образовываться с альфавирусными оболочками и ретровирусными капсидами. Такие химеры называются псевдотипированными вирусами. Альфавирусные псевдотипы оболочки ретровирусов или лентивирусов способны интегрировать гены, которые они несут, в обширный диапазон потенциальных клеток-хозяев, которые распознаются и инфицируются белками оболочки альфавирусов E2 и E1. Стабильная интеграция вирусных генов опосредована ретровирусной внутренней частью этих векторов.
Существуют ограничения на использование альфавирусов в области генной терапии из-за отсутствия у них таргетинга, однако за счет введения вариабельных доменов антител в неконсервативную петлю в структуре E2 мишенями становятся определенные популяции клеток. Кроме того, использование цельных альфавирусов для генной терапии имеет ограниченную эффективность как из-за того, что несколько внутренних альфавирусных белков участвуют в индукции апоптоза при инфицировании, так и из-за того, что альфавирусный капсид опосредует только временное введение мРНК в клетки-хозяева.
Ни одно из этих ограничений не распространяется на псевдотипы альфавирусной оболочки ретровирусов или лентивирусов. Однако экспрессия оболочек вируса Синдбис может привести к апоптозу, а их введение в клетки-хозяева при заражении псевдотипированными ретровирусами оболочки вируса Синдбис также может привести к гибели клеток. Токсичность вирусных оболочек Sindbis может быть причиной очень низких титров продукции, полученных из упаковочных клеток, сконструированных для производства псевдотипов Sindbis. Еще одно направление исследований с участием альфавирусов — вакцинация. Альфавирусы могут быть сконструированы для создания векторов репликонов, которые эффективно индуцируют гуморальный и Т-клеточный иммунный ответ. Поэтому их можно использовать для вакцинации против вирусных, бактериальных, простейших и опухолевых антигенов.
История
[править | править код]Первоначально семейство Togaviridae включало то, что сейчас называется Flaviviruses, в пределах рода Alphavirus. Флавивирусы были сформированы в свое собственное семейство, когда были отмечены достаточные различия с альфавирусами благодаря развитию секвенирования[15]. Вирус краснухи ранее был включен в семейство Togaviridae в отдельный род Rubivirus, но теперь классифицируется в отдельное семейство Matonaviridae[16]. Alphavirus в настоящее время является единственным родом в семействе.
- 1930 г. - вирус западного энцефалита лошадей впервые выделен в Соединенных Штатах (первый из когда-либо выделенных альфавирусов).
- 1933 г. – в США впервые выделен вирус восточного энцефалита лошадей .
- 1938 г. – выделен венесуэльский лошадиный энцефалит .
- 1941 г. - в США наблюдается эпидемия западного лошадиного энцефалита. Он затрагивает 300 000 лошадей и 3336 человек.
- 1941 – Норман Грегг замечает большое количество детей с катарактой после вспышки краснухи. Этот и другие дефекты классифицируются как синдром врожденной краснухи .
- 1942 г. - вирус леса Семлики выделен в Булияме, округ Бвамба, Уганда.
- 1952 г. - вирус Синдбис выделен в медицинском округе Синдбис, 40 mi (64 км) . к северу от Каира, Египет .
- 1959 г. – Вирус реки Росс выделен от комаров Aedes vigilax (теперь известных как Ochlerotatus vigilax )[17], которые были отловлены в реке Росс в Австралии.
- 1963 г. - Доэрти и его коллеги выделяют вирус Росс-Ривер, вызывающий эпидемический полиартрит (в основном наблюдаемый в Австралии)[18].
- 1971 - Последняя эпидемия венесуэльского лошадиного энцефалита наблюдается у лошадей в южном Техасе[19].
- 1986 г. - вирус леса Барма идентифицирован как вызывающий заболевание человека в Австралии[20].
- 2001 — Ученые раскрыли кристаллическую структуру гликопротеиновой оболочки вируса леса Семлики .
- 2005–2006 гг. — крупная эпидемия вируса чикунгунья на острове Реюньон и прилегающих островах в Индийском океане [21] .
- 2006 г. - крупная эпидемия вируса чикунгунья в Индии, зарегистрировано более 1,5 миллиона случаев[22].
См. также
[править | править код]Источники
[править | править код]- ↑ Таксономия вирусов (англ.) на сайте Международного комитета по таксономии вирусов (ICTV).
- ↑ "Understanding the Mechanisms Underlying Host Restriction of Insect-Specific Viruses". Viruses. 12 (9): 964. 2020-08-31. doi:10.3390/v12090964. PMID 32878245.
{{cite journal}}: Википедия:Обслуживание CS1 (не помеченный открытым DOI) (ссылка) - ↑ 1 2 Vénien-Bryan C, Fuller SD (February 1994). "The organization of the spike complex of Semliki Forest virus". J. Mol. Biol. 236 (2): 572—83. doi:10.1006/jmbi.1994.1166. PMID 8107141.
- ↑ "The Fusion glycoprotein shell of Semliki Forest virus: an icosahedral assembly primed for fusogenic activation at endosomal pH". Cell. 105 (1): 137—48. April 2001. doi:10.1016/S0092-8674(01)00303-8. PMID 11301009.
- ↑ "Structural and functional insights into alphavirus polyprotein processing and pathogenesis". Proc Natl Acad Sci U S A. 109 (41): 16534—9. 2012. Bibcode:2012PNAS..10916534S. doi:10.1073/pnas.1210418109. PMID 23010928.
- ↑ Spuul, P (May 2011). "Assembly of alphavirus replication complexes from RNA and protein components in a novel trans-replication system in mammalian cells". Journal of Virology. 85 (10): 4739—51. doi:10.1128/JVI.00085-11. PMID 21389137.
- ↑ "Genome scale phylogeny of the Alphavirus genus suggests a marine origin". J Virol. 86 (5): 2729—38. December 2011. doi:10.1128/JVI.05591-11. PMID 22190718.
- ↑ "Complete sequence of the genomic RNA of O'nyong-nyong virus and its use in the construction of alphavirus phylogenetic trees". Virology. 175 (1): 110—123. 1990. doi:10.1016/0042-6822(90)90191-s. PMID 2155505.
- ↑ Virus Taxonomy: 2020 Release. International Committee on Taxonomy of Viruses (ICTV) (март 2021). Дата обращения: 15 мая 2021. Архивировано 20 марта 2020 года.
- ↑ "Identification of a novel alphavirus related to the encephalitis complexes circulating in southern Brazil". Emerging Microbes & Infections. 8 (1): 920—933. 2019. doi:10.1080/22221751.2019.1632152. PMID 31237479.
{{cite journal}}: Недопустимый|display-authors=6(справка) - ↑ "Evolutionary relationships and systematics of the alphaviruses". J. Virol. 75 (21): 10118—31. November 2001. doi:10.1128/JVI.75.21.10118-10131.2001. PMID 11581380.
- ↑ "Phylogeographic structure and evolutionary history of Sindbis virus". Vector Borne Zoonotic Dis. 10 (9): 889—907. November 2010. doi:10.1089/vbz.2009.0069. PMID 20420530.
- ↑ "A comparison of the nucleotide sequences of eastern and western equine encephalomyelitis viruses with those of other alphaviruses and related RNA viruses". Virology. 197 (1): 375—90. November 1993. doi:10.1006/viro.1993.1599. PMID 8105605.
- ↑ "Genetic diversity and slow rates of evolution in New World alphaviruses". Curr. Top. Microbiol. Immunol. 176: 99—117. 1992. doi:10.1007/978-3-642-77011-1_7. ISBN 978-3-642-77013-5. PMID 1318187.
- ↑ Togaviridae. stanford.edu. Дата обращения: 19 августа 2022. Архивировано 19 августа 2022 года.
- ↑ ICTV Taxonomy List. Дата обращения: 5 мая 2020. Архивировано 20 марта 2020 года.
- ↑ Aedes vigilax. NSW Arbovirus Surveillance & Vector Monitoring Program. The New South Wales Arbovirus Surveillance and Mosquito Monitoring Program. — «Note that 'Ochlerotatus vigilax' prior to 2000, was known as 'Aedes vigilax'». Дата обращения: 5 июня 2010. Архивировано из оригинала 19 марта 2018 года.
- ↑ "Isolation of Ross River virus from man". The Medical Journal of Australia. 1 (21): 1083—4. May 1972. doi:10.5694/j.1326-5377.1972.tb116646.x. PMID 5040017.
- ↑ "Medically important arboviruses of the United States and Canada". Clinical Microbiology Reviews. 7 (1): 89—116. January 1994. doi:10.1128/CMR.7.1.89. PMID 8118792.
- ↑ "Illness caused by a Barmah Forest-like virus in New South Wales". The Medical Journal of Australia. 148 (3): 146—7. February 1988. doi:10.5694/j.1326-5377.1988.tb112780.x. PMID 2828896.
- ↑ "Infectious clones of Chikungunya virus (La Réunion isolate) for vector competence studies". Vector Borne and Zoonotic Diseases. 6 (4): 325—37. 2006. doi:10.1089/vbz.2006.6.325. PMID 17187566.
- ↑ "Emergence of chikungunya virus in Indian subcontinent after 32 years: A review". Journal of Vector Borne Diseases. 43 (4): 151—60. December 2006. PMID 17175699.
- Arboviruses. Virology-online.
- ICTV Sources. ICTV. Архивировано из оригинала 12 февраля 2006 года.
- Smerdou, C.; Liljestrom, P. (2000). "Alphavirus vectors: from protein production to gene therapy". Gene Therapy and Regulation. 1 (1): 33—63. doi:10.1163/156855800744520. ISSN 1568-5586.
- Rayner JO, Dryga SA, Kamrud KI (2002). "Alphavirus vectors and vaccination". Reviews in Medical Virology. 12 (5): 279—96. doi:10.1002/rmv.360. PMID 12211042. S2CID 21432844.
- Rhême, Céline; Ehrengruber, Markus U.; Grandgirard, Denis (2005). "Alphaviral cytotoxicity and its implication in vector development". Experimental Physiology. 90 (1): 45—52. doi:10.1113/expphysiol.2004.028142. PMID 15542620.
- Schmaljohn, Alan L. 54. Alphaviruses (Togaviridae) and Flaviviruses (Flaviviridae) // Medical Microbiology / Alan L. Schmaljohn, David McClain. — 4th. — University of Texas Medical Branch at Galveston, 1996. — ISBN NBK7633.