| Вирус гепатита C | ||||||
|---|---|---|---|---|---|---|
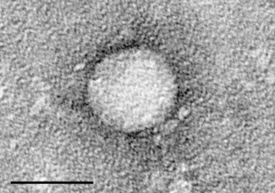 Электронная микрофотография "Вируса гепатита C", очищенного от клеточной культуры. Размер = 50 нанометров | ||||||
| Научная классификация | ||||||
|
Реалм: Царство: Тип: <i>Kitrinoviricota</i> Класс: Flasuviricetes Порядок: Amarillovirales Семейство: Вид: Вирус гепатита C |
||||||
| Международное научное название | ||||||
| Hepacivirus C | ||||||
| ||||||

Вирус гепатита C (лат. Hepacivirus C, HCV) — вирус-возбудитель гепатита C у человека и шимпанзе. РНК-содержащий вирус, относящийся к семейству Flaviviridae (род Hepacivirus; в этот же род входят вирусы, вызывающие заболевания, похожие на гепатит C, у собак и лошадей[2][3]). Открыт в 1989 г. методом клонирования ДНК-копии вируса, вызывавшего парентеральный гепатит «ни А ни В» у инфицированных шимпанзе. Это первый вирус, идентифицированный на основании расшифровки последовательности нуклеотидов задолго до его электронно-микроскопической визуализации[4][5]. Согласно классификации вирусов по Балтимору относится к классу IV. К настоящему времени этим вирусом инфицировано не менее 3 % населения Земли[6].
В 2020 г. Нобелевская премия по медицине была присуждена американским вирусологам Харви Олтеру, Чарльзу Райсу и британцу Майклу Хаутону за открытие вируса гепатита C[7][8][9].
История открытия
Первые работы, в итоге успешно закончившиеся идентификацией вируса и установлением его патологической роли в заболеваниях печени, были начаты ещё в начале 1970-х годов Харви Алтером. Алтер, работая в системе Национальных институтов здравоохранения США, пытался выяснить причины заражения гепатитом при переливаниях крови (в то время вероятность заражения гепатитом в результате гемотрансфузий доходила до 30 %), исследуя образцы крови, переливание которых впоследствии вызывало гепатит у здоровых реципиентов. К 1975 г. он установил, что, вероятно, за часть случаев гепатита отвечает ещё не открытый вирус. В конце 1970-х годов Алтер экспериментально доказал предположение об инфекционной природе нового заболевания путём переливания сыворотки крови шимпанзе от доноров, чья кровь вызывала заболевания гепатитом[10].
Длительное время не удавалось определить, что же именно вызывает гепатит C. В 1982 г. Майкл Хаутон начал лабораторные исследования по идентификации возбудителя гепатита C. К концу 1980-х годов ему удалось добиться успеха, применив новый подход — молекулярное клонирование фрагментов генома вирусов в бактериях[11]. Благодаря работам Хаутона и руководимой им группы исследователей удалось не только идентифицировать возбудитель, но и внедрить в повсеместное использование скрининговые тесты (их начали применять с 1990 г.), что позволило резко снизить частоту гемотрансфузионных заражений.
Чарльз Райс явился основоположником работ по изучению вируса гепатита C в лабораторных условиях с использованием модельных животных и клеточных культур[12]. Изначально шимпанзе были единственным видом животных, которых был способен инфицировать вирус гепатита C. Но исследования на человекообразных обезьянах очень дороги и сложны и, что самое главное, на них накладываются очень строгие этические ограничения. Эти обстоятельства очень затрудняют получение новых актуальных данных. В 2000 г. возглавляемая Райсом команда исследователей сообщила об успешном опыте культивирования вируса гепатита C в клеточной линии рака печени человека. Кроме того, они достигли успеха и в создании химерной линии мышей с отключённым иммунитетом, у которых печень состоит из человеческих гепатоцитов, что делает их восприимчивыми к человеческому вирусу (отсутствие иммунитета предотвращает отторжение чужеродных клеток). Благодаря работам Райса и его группы удалось детально изучить биологию вируса и начать поиск эффективных лекарств (первые подобные работы были начаты именно в его лаборатории).
В 2020 г. Алтер, Хаутон и Райс были удостоены Нобелевской премии по физиологии и медицине за открытие вируса гепатита C и установление его роли в развитии заболеваний печени у человека. Все трое лауреатов принимали ранее и принимают сейчас активное участие в работах по созданию вакцины против вируса гепатита C[13].
Строение

Геном
Геном вируса представлен однонитевой линейной (+)РНК размером около 9400 нуклеотидов, которая способна выполнять функцию как мРНК, так и служить матрицей для синтеза дочерних копий вирусного генома.[14] В геноме содержится всего один ген, который кодирует 9 различных белков. Изначально РНК вируса гепатита C транслируется с образованием полипептида длиной около 3000 аминокислот. В геноме вируса содержится два некодирующих региона и одна большая открытая рамка считывания, кодирующая структурные и неструктурные белки. Гены, кодирующие структурные белки, расположены в области 5'-конца цепочки РНК, а неструктурные — в области 3'-конца. К структурным белкам относятся core, Е1 и Е2 белки. Сore-белок является белком нуклеокапсида, он обладает РНК-связывающей активностью, модулирует транскрипцию и трансляцию некоторых клеточных генов и обладает онкогенным потенциалом. Именно с core-белком связывают выраженность прямого цитопатического эффекта вируса гепатита C. Е1 и Е2 белки — гликопротеины внешней оболочки вируса высоковариабельны, а их С-концевые части гидрофобны и могут принимать участие во взаимодействии с клеточной мембраной. В структурной зоне кодируется также пептид р7, играющий важную роль в высвобождении вириона из инфицированной клетки. Неструктурная область вирусного генома кодирует 6 белков — NS2, NS3, NS4A, NS4B, NS5A и NS5B. Функции NS2 и NS4 предположительно связывают с клеточной мембраной. Кроме того, белок NS2 является вирусной цинк-зависимой протеиназой и вместе с клеточными пептидазами участвует в аутокаталитическом нарезании самого себя из вирусного полипротеина. Белок NS3 — это вирусная протеиназа, играющая важную роль в процессинге вирусных белков. Белок NS4A действует как эффектор или кофактор для NS3, он регулирует фосфорилирование белка NS5A, который обладает функцией репликазы. Имеется ряд доказательств, что от NS5A зависит резистентность к IFN-α, так как в нём выделен регион, участвующий в ингибировании индуцируемой IFN-α протеинкиназы. Белок NS5B является вирусной РНК-зависимой РНК-полимеразой. Согласно современным представлениям, в инфицированной клетке белки NS4A, NS4B, NS5A и NS5B вместе с белком NS3 ассоциируются в некую структуру, которая играет важную роль в вирусной репликации. Высокая консервативность 5′- и 3′- некодирующих регионов и их важная роль в репликации вируса делают их перспективными мишенями для разработки средств лечения и профилактики вирусного гепатита C.
Одной из важнейших особенностей генома HCV является его выраженная геномная гетерогенность, обусловленная высоким уровнем репродукции и частотой возникновения ошибок при репликации (по этой причине HCV, фактически, существует как квазивид, состоящий из нескольких генотипов и множества подтипов, способных к генетической рекомбинации; что, впрочем, характерно для многих РНК-вирусов). Скорость продукции вирусных частиц достигает 1011−1012 в сутки с периодом полужизни вирусных частиц от 2,2 до 7,2 ч. (в среднем около 3 ч.). Оценочно каждый заражённый гепатоцит ежесуточно продуцирует около 50 вирионов. Подверженность мутациям отдельных участков генома различна (наиболее вариабельными являются области, кодирующие гликопротеины внешней оболочки Е2 и Е1). Подобная мультивариантность HCV приводит к постоянному состязанию между образованием новых антигенных вариантов и продукцией нейтрализующих антител, что обеспечивает «ускользание» из-под иммунологического надзора, а также формирование резистентности к противовирусным препаратам и длительную многолетнюю хроническую персистенцию HCV в организме.

Считается, что генетический материал HCV не способен интегрироваться в геном инфицированных клеток[4][5][15].
Структура вириона
Размер вирионов составляет 30—50 нм.
В крови около 75 % вирусных частиц ассоциированы с липопротеинами низкой и очень низкой плотности. Синтез липопротеинов происходит в эндоплазматическом ретикулюме (ЭПР) гепатоцитов, где они, предположительно, взаимодействуют с белковолипидной оболочкой HCV, образуя комплекс (т. н. липовирусные частицы). В составе такого комплекса вирусные частицы защищены от воздействия антител и, за счёт взаимодействия с рецепторами ЛПН, проникают в клетки (в первую очередь в гепатоциты). Также в механизмах проникновения липовирусных частиц вируса гепатита C в клетки участвует рецептор SR-BI (рецептор липопротеинов высокой плотности).
Частицы вируса имеют белково-липидную оболочку, сформированную липидами инфицированных клеток и поверхностными белками вируса. Под оболочкой располагается нуклеокапсид икосаэдрической формы, который сформирован сердцевинным (core) белком и содержит вирусную РНК. Размеры нуклеокапсида составляют 33—40 нм.
Детальное строение вируса гепатита C до сих пор не выяснено, что обусловлено низким содержанием вируса в крови инфицированных людей и животных (в клеточных культурах вирус не размножается) и способностью вирусных частиц образовывать комплексы с антителами и липопротеинами крови[4][5][15].
Жизненный цикл вируса

РНК вируса, составляющая материальную основу его генома, может выступать в качестве мРНК, целиком транслирующейся на рибосомах ЭПР инфицированных клеток. В результате такой полной трансляции образуется полипротеин, содержащий в себе все вирусные белки. Полипротеин расщепляется на функциональные белки с помощью клеточных и вирусных протеаз (образуется 3 структурных белка, затем входящих в состав зрелого вируса, и 7 неструктурных белков, обеспечивающих репликацию HCV)[6]. Процессы фолдинга и пострансляционых модификаций белков Е1 и Е2 целиком проходят в пространстве ЭПР.
На геномной РНК вируса, выступающей в качестве матрицы для воспроизведения, происходит и синтез дочерних копий вирусного генома при участии специфической вирусной РНК-полимеразы, образующейся в результате расщепления полипротеина. Благодаря этому геномная РНК вируса гепатита C обладает самостоятельной инфицирующей способностью (она способна инфицировать клетки даже попадая в них в «голом виде», то есть не в составе зрелых вирионов), что впрочем, характерно для всех вирусов класса IV классификации Балтимора. Дочерние копии вирусного генома, в свою очередь, могут выступать как в роли мРНК, так и входить в состав новых вирионов, продуцируемых инфицированными клетками[16].
Сборка частиц ВГС осуществляется в мембранах эндоплазматического ретикулума, вакуолях аппарата Гольджи и цитоплазме. Сердцевинный белок остается на цитоплазматической поверхности ЭПР и в липидных вакуолях цитоплазмы, а оболочечные белки частично проникают во внутреннюю полость ЭПР. В эндоплазматической сети белки Е1 и Е2 формируют комплекс и подвергаются процессингу, который, вероятно, заканчивается в секреторных вакуолях аппарата Гольджи. Нуклеокапсид после упаковки РНК покрывается оболочкой, и вирус выпочковывается в цистерны ЭПР. Сформировавшиеся вирусные частицы покидают клетку в составе секреторных вакуолей. Скорость образования вирионов у пациентов с хронической ВГС-инфекцией может достигать 1012 частиц в сутки.
Помимо рецептора ЛПН, в механизмах проникновения вируса в клетки участвует рецептор CD81 (экспонированный на поверхности большинства клеток). Считается, что посредством связывания с этим рецептором в клетки проникают вирусные частицы, не ассоциированные с липопротеинами.
HCV обладает тропизмом не только к печени, но и к некоторым другим тканям и органам. Он способен, в частности, реплицироваться в клетках иммунной системы, включая моноциты/макрофаги и В-клетки, в дендритных клетках, гематопоэтических клетках-предшественниках, микроглии, кардиомиоцитах, кишечном эпителии, остеобластах и В-клеточных фолликулах лимфатических узлов. Показано, что инфицированные лимфоидные клетки могут быть причиной заражения здоровой печени при её трансплантации. Внепечёночный резервуар инфекции может служить источником реактивации болезни после прекращения интерферонотерапии, а также играть роль в развитии таких патологических процессов иммунной системы, как лимфома В-клеток и смешанная криоглобулинемия[4][5].
Подтипы вируса
Известно 8 основных генотипов HCV, которые, на основании различий в первичной структуре РНК, подразделяются более чем на 100 подтипов. Типы вируса гепатита C обозначаются арабскими цифрами (1-8), а подтипы — латинскими буквами (1a, 1b, 2a и т. д.). Каждый из вирусных генотипов обладает своими особенностями патогенеза и путей передачи, что обуславливает важность правильной и точной диагностики и существенные различия в применяемой антивирусной терапии. 1b-генотип чаще приводит к развитию цирроза и гепатоцеллюлярной карциномы печени. Подтипы 1a и 3b передаются, преимущественно, «шприцевым» методом, в силу чего наиболее распространены у лиц, принимающих внутривенные наркотики. 1b подтип чаще всего передаётся при переливаниях крови.
Генотипы HCV значительно различаются по своей географической распространённости. Так, к примеру, генотип 6 распространён, преимущественно, в Юго-Восточной Азии. Генотип 4 — в Северной и Центральной Африке, 5- в Южной Африке. В Японии преобладает генотип 1b. В США — 1a генотип. В европейской части России преобладают 1b и 3a генотипы[4][17].
Инфицирование одним генотипом не даёт иммунитета против инфицирования другим типом, поэтому возможно одновременное заражение двумя и более штаммами. В большинстве из этих случаев один из штаммов доминирует над другим[15].
HCV способен к генетической рекомбинации между своими генотипами, подтипами генотипов и штаммами одного и того же подтипа[18].
Происхождение вируса
Все существующие генотипы, по всей видимости, произошли от генотипа 1b. Современные методы молекулярно-эволюционных исследований показывают, что генотипы 2-6 образовались около 300—400 лет назад, а деление их на подтипы началось около 200 лет назад[19][20]. Окончательно современный спектр подтипов вируса гепатита C сформировался к середине XX века.
Эволюционное происхождение HCV до сих пор остаётся невыясненным, однако общепринятой является точка зрения о его зоонозном происхождении: вероятно, вирус передался человеку от летучих мышей и/или грызунов[21]. Данные эволюционно-филогенетических исследований свидетельствуют о том, что прародиной вируса является Африка. Расцвет работорговли в конце XVII в. положил начало выходу вируса за пределы Африканского континента и повсеместному его распространению среди населения Земли (основным — магистральным — направлением распространения был регион Карибского бассейна). Но эволюционный анализ вируса генотипа 3 свидетельствует о том, что этот генотип начал распространяться ещё во времена арабской работорговли между Юго-Восточной Африкой, Ближним Востоком и Южной Азией. В эпоху колониализма африканские колонии послужили источником распространения вируса в страны Европы. Но вплоть до начала XX в. темпы распространения HCV в человеческой популяции были низкими, а уровень общей заболеваемости — невысоким. И только в XX столетии произошло по-настоящему глобальное распространение HCV среди населения Земли, сопровождавшееся повсеместным резким подъёмом заболеваемости с формированием отдельных эпидемически неблагополучных регионов. Можно выделить несколько волн распространения ВГС в XX в.: 1. Первая Мировая Война, сопровождавшаяся первыми по-настоящему массовыми миграциями населения между разными регионами Земного шара (в первую очередь между Европой, Юго-Восточной Азией и Северной Америкой) 2. Вторая Мировая Война, также сопровождавшаяся массовыми миграциями и широким внедрением в медицинскую практику гемотрансфузий и методов внутривенного введения лекарственных препаратов 3. кампании по массовой вакцинации населения Земли от различных инфекционных заболеваний, начатые в 50-е годы XX в. 4. распространение героиновой наркомании начиная с 60-х гг. XX в[22].
Устойчивость во внешней среде
Устойчив к температурам до 50 °С, но инактивируется при более высоких температурах, под действием органических растворителей, УФ-излучения и распространённых дезинфектантов. В целом вирус малоустойчив во внешней среде[16].
Иммуногенность
HCV обладает слабой иммуногенностью, в силу чего вызывает лишь мало выраженный и растянутый во времени иммунный ответ (специфические антитела, к тому же обладающие слабым вируснейтрализующим действием, начинают образовываться не ранее чем через 2 недели после попадания вируса в организм). Это же обстоятельство является причиной того, что HCV способен вызывать повторную инфекцию у людей, переболевших в острой форме и выздоровевших. До 60 % людей, перенесших вирусный гепатит C с выздоровлением, не имеют антител к антигенам HCV уже через 3 года (а у тех индивидуумов, в крови которых антитела обнаруживаются более длительный срок, они содержатся в низком титре)[4][16].
Вакцина против гепатита C
Попытки создания вакцины, несмотря на активные исследования практически с момента идентификации возбудителя в 1989 г., до сих пор не привели к успеху. Большинство специалистов скептически относится к самой возможности создания классической вакцины против гепатита C. В настоящее время основные усилия в этой области сосредоточены на поиске и разработке средств стимуляции клеточных механизмов противовирусного иммунитета посредством, в частности, ДНК-вакцин[4][17][16][23].
См. также
Примечания
- ↑ Таксономия вирусов (англ.) на сайте Международного комитета по таксономии вирусов (ICTV).
- ↑ A. Kapoor, P. Simmonds, G. Gerold, N. Qaisar, K. Jain. Characterization of a canine homolog of hepatitis C virus (англ.) // Proceedings of the National Academy of Sciences. — National Academy of Sciences, 2011-07-12. — Vol. 108, iss. 28. — P. 11608—11613. — ISSN 1091-6490 0027-8424, 1091-6490. — doi:10.1073/pnas.1101794108.
- ↑ P. D. Burbelo, E. J. Dubovi, P. Simmonds, J. L. Medina, J. A. Henriquez. Serology-Enabled Discovery of Genetically Diverse Hepaciviruses in a New Host (англ.) // Journal of Virology. — 2012-06-01. — Vol. 86, iss. 11. — P. 6171—6178. — ISSN 0022-538X. — doi:10.1128/JVI.00250-12.
- ↑ 1 2 3 4 5 6 7 Л.И. Николаева. Вирус гепатита C: антигены вируса и реакция на них иммунной системы макроорганизма:информационно-методическое пособие. — Новосибирск: Вектор-Бест, 2009. — 78 с.
- ↑ 1 2 3 4 Научная электронная библиотека. monographies.ru. Дата обращения: 2 апреля 2020.
- ↑ 1 2 Есть ли у нас шансы на победу над гепатитом C? • Новости науки. «Элементы». Дата обращения: 9 июня 2020. Архивировано 9 июня 2020 года.
- ↑ Deutsche Welle (www.dw.com). Лауреатами Нобелевской премии по медицине стали трое вирусологов из США и Великобритании | DW | 05.10.2020 (рус.). DW.COM. Дата обращения: 7 октября 2020. Архивировано 11 октября 2020 года.
- ↑ Елена Плавская. Названы лауреаты Нобелевской премии по медицине за 2020 год. Известия (5 октября 2020). Дата обращения: 7 октября 2020. Архивировано 8 октября 2020 года.
- ↑ Нобелевскую премию по медицине присудили за открытие вируса гепатита C. РИА Новости (20201005T1237). Дата обращения: 7 октября 2020. Архивировано 6 октября 2020 года.
- ↑ Tabor E., Gerety R. J., Drucker J. A., Seeff L. B., Hoofnagle J. H., Jackson D. R., April M., Barker L. F., Pineda-Tamondong G. Transmission of non-A, non-B hepatitis from man to chimpanzee. (англ.) // Lancet (London, England). — 1978. — 4 March (vol. 1, no. 8062). — P. 463—466. — doi:10.1016/s0140-6736(78)90132-0. — PMID 76018.
- ↑ Houghton, M (2009). "The long and winding road leading to the identification of the hepatitis C virus". J. Hepatol. 51 (5): 939—948. doi:10.1016/j.jhep.2009.08.004. PMID 19781804.
- ↑ Nair, P. (April 18, 2011). "Profile of Charles M. Rice". Proceedings of the National Academy of Sciences. 108 (21): 8541—8543. doi:10.1073/pnas.1105050108. PMC 3102406. PMID 21502493.
- ↑ Нобелевская премия по физиологии и медицине — 2020 • Новости науки. «Элементы». Дата обращения: 9 октября 2020. Архивировано 2 марта 2022 года.
- ↑ Kato N (2000). "Genome of human hepatitis C virus (HCV): gene organization, sequence diversity, and variation". Microb. Comp. Genom. 5 (3): 129—51. doi:10.1089/mcg.2000.5.129. PMID 11252351.
- ↑ 1 2 3 Ксения Щербак. Вирус гепатита C (HCV, ВГС). Гепатит C - сайт и форум о диагностике и лечении вирусных гепатитов. Дата обращения: 2 апреля 2020. Архивировано 3 марта 2022 года.
- ↑ 1 2 3 4 А.И. Зинченко, Д.А. Паруль. Основы молекулярной биологии вирусов и антивирусной терапии. — Минск: Вышэйшая школа, 2005. — С. 164. — 214 с. — ISBN 985-06-1049-2.
- ↑ 1 2 А. И. Мигунов. Гепатит. Современный взгляд на лечение и профилактику. — СПб.: Весь, 2014. — С. 39. — 128 с. — ISBN 978-5-9573-0519-4.
- ↑ Fernando González-Candelas, F. Xavier López-Labrador, and María Alma Bracho. Recombination in Hepatitis C Virus (англ.) // Viruses : журнал. — 2011. — 3 October. — P. 2006-2024. Архивировано 27 декабря 2021 года.
- ↑ Muhammad T Sarwar, Humera Kausar, Bushra Ijaz, Waqar Ahmad, Muhammad Ansar. NS4A protein as a marker of HCV history suggests that different HCV genotypes originally evolved from genotype 1b // Virology Journal. — 2011-06-23. — Т. 8. — С. 317. — ISSN 1743-422X. — doi:10.1186/1743-422X-8-317. Архивировано 22 февраля 2020 года.
- ↑ Marco Salemi, Anne-Mieke Vandamme. Hepatitis C Virus Evolutionary Patterns Studied Through Analysis of Full-Genome Sequences (англ.) // Journal of Molecular Evolution. — 2002-01-01. — Vol. 54, iss. 1. — P. 62—70. — ISSN 1432-1432. — doi:10.1007/s00239-001-0018-9.
- ↑ Вирус гепатита C: откуда он взялся? BBC News Україна (2 мая 2013). Дата обращения: 3 февраля 2022. Архивировано 3 февраля 2022 года.
- ↑ А. Б. Жебрун, О. В. Калинина. ВИРУСНЫЙ ГЕПАТИТ C: ЭВОЛЮЦИЯ ЭПИДЕМИЧЕСКОГО ПРОЦЕССА, ЭВОЛЮЦИЯ ВИРУСА // Журнал микробиологии, эпидемиологии и иммунобиологии. — 2016-02-28. — Т. 0, вып. 1. — С. 102–112. — ISSN 2686-7613. — doi:10.36233/0372-9311-2016-1-102-112. Архивировано 3 февраля 2022 года.
- ↑ Обезвредить ласкового убийцу. Когда появится вакцина от гепатита C. РИА Новости (20190728T0800+0300). Дата обращения: 2 апреля 2020. Архивировано 18 сентября 2020 года.
Обычно почти сразу, изредка в течении часа.